揭示铁出口铁转运蛋白的意想不到的结构
体内铁过多或过少都会导致疾病,但是有机体已开发出使铁水平保持平衡的方法。Ferroportin是唯一已知的将铁释放到血液中的铁出口商,是铁平衡机制的关键组成部分。
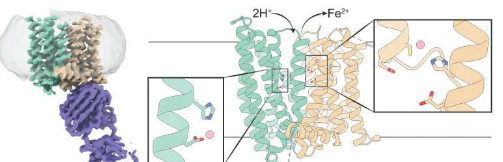
为了更好地了解铁调节,贝勒医学院的研究人员领导的一个小组分析了哺乳动物铁转运蛋白的3-D结构,揭示了意想不到的特征和新颖的作用方式,可以指导创新治疗策略的发展。该研究发表在《自然通讯》上。
相应的作者Ming Zhou博士说:“铁转运蛋白基因的60多个突变与人类疾病有关。其中一些突变使铁转运蛋白对肝素(一种在肝脏中合成的,有助于铁转运蛋白调节的肽激素)不敏感。” Bowman Bowers生物化学和分子生物学教授。周先生还是贝勒(Baylor)丹·邓肯综合癌症中心(Dan L Duncan综合癌症中心)的成员。
Ferroportin和hepcidin协调其活动,以使体内铁保持适当的平衡。铁转运蛋白将铁输出到血液中,铁调素控制了铁的输出不超过需求。当它对铁调素没有反应时,铁转运蛋白仍然保持活性。因此,人体会承受铁的负担,这种疾病被称为铁超负荷疾病。
贝勒大学生物化学和分子生物学助理教授,共同第一作者潘亚平博士说:“我们希望通过研究铁转运蛋白的结构来更好地理解铁运输的调控过程。” “既没有描述铁转运蛋白的结构,也没有描述铁转运蛋白和铁调素的结构。仔细观察这些结构将提供关于铁转运蛋白如何起作用以及铁调素如何调节其活性的新见解,为治疗铁超负荷疾病的新方法开辟了可能性。 ”
具有挑战性的蛋白质
研究人员从灵长类动物菲律宾眼镜猴中研究了铁转运蛋白,该铁转运蛋白与人铁转运蛋白的相似度超过90%。以前研究细菌铁转运蛋白和其他铁转运蛋白的研究表明,这些蛋白质只有一个铁结合位点,它们一次带有一个铁基团。
“我们的假设是,tarsier ferroportin也具有一个铁结合位点,并且对我们的实验结果感到困惑,因此开始了我们的研究,”第一作者,实验实验室的定量和计算生物科学研究生沈洁敏说。
例如,该团队进行了实验,以确定改变铁结合位点如何影响铁转运蛋白的3-D结构。当他们发现更改站点似乎没有产生太大影响时(与他们的预期相反),他们对此很感兴趣。一旦我们用冷冻电子显微镜揭示了铁转运蛋白的结构,我们就意识到它有两个铁结合位点。令人惊讶的是,这解释了使我们感到困惑的数据。”
沉说:“我们只改变了一个位点,似乎另一个位点仍在结合铁工作,因此我们没有看到铁转运蛋白的结构有太大变化。”
第二个令人振奋的发现是,眼镜猴铁转运蛋白的作用方式与其他铁转运蛋白所报道的方式不同。”
潘说:“铁离子转运蛋白铁蛋白出口带两个正电荷。我们发现,当铁转运蛋白铁蛋白出口时,带正电荷的质子被转运到细胞内,平衡电荷并促进铁的进一步出口。”
“我们正在利用这些新的结构和功能发现来鉴定可以调节铁转运蛋白的小分子候选物。我们也在研究人类铁转运蛋白,” Zhou说。“该项目具有将研究结果转化为病床的巨大潜力。”
标签: 转运蛋白
